Curr Opin Insect Sci 特邀综述丨中科院深圳先进技术研究院刘畅研团队综述果蝇中睡眠和记忆的整合神经环路机制-知乎
越来越多的证据揭示睡眠和记忆高度相关:睡眠有助于巩固和强化记忆,睡眠不足或异常可导致记忆受损。尽管研究人员对睡眠和记忆的神经调控机制开展了一系列的研究,但因二者都是连续的、复杂的生理过程,其相互影响的物质基础依然不清楚,是神经科学领域的前沿问题之一。人脑有约860亿个神经元,构成错综复杂的神经纤维网络,深度解析睡眠和记忆共调控的机制仍面临着巨大的挑战。因此,利用相对简单的模式生物开展研究,可以阐明分子和神经机制,理解生命世界的一般规律,并为高等动物乃至人类的研究奠定理论基础并提供借鉴意义。黑腹果蝇,仅有10万个神经元的大脑结构相对简单,但其神经系统高度连接且功能异质,进化中的这种简约的特质,加之丰富而强大的遗传操作体系,使之成为研究睡眠和记忆共调控的理想模型。目前研究已鉴定出果蝇脑内分别调控睡眠和记忆的脑区和细胞类型,但是在分子和环路水平上共调控的机制依然知之甚少。
中国科学院深圳先进技术研究院刘畅研究员受邀就睡眠和记忆的整合神经环路撰写综述,论述并讨论最新的研究进展以及未来的研究方向和新思路。近日,伍立桃博士和刘畅研究员共同撰写的题为 “Integrated neural circuits of sleep and memory regulation in Drosophila”正式发表在Current Opinion in Insect Science期刊上。(拓展阅读:刘畅团队组相关研究进展,详见“逻辑神经科学”报道(点击阅读):J Neurosci︱深圳先进院刘畅课题组揭示果蝇椭球体环状神经元亚型在睡眠调控中的特异性作用)

该综述从以下几方面展开论述:1)整合了现阶段已知的以蘑菇体为核心的调控果蝇嗅觉记忆形成、巩固、遗忘和提取的关键神经元类型以及神经结构和功能环路;2)果蝇蘑菇体中调控记忆的神经元在睡眠调控中的作用,整合了新近有关睡眠依赖和睡眠不依赖的记忆环路的作用模式;3)总结了果蝇蘑菇体环路中已鉴定睡眠调控功能但环路机制未知的细胞类型,并拓展了其他的睡眠和记忆共调控的环路和神经网络靶点。该文全面的归纳总结了果蝇脑内学习记忆和睡眠共调控的神经元类型及神经环路基础,为未来潜在的研究方向提供了新思考。
一、果蝇蘑菇体中调控记忆的神经元和环路
果蝇的记忆需多种类型的神经元参与,经典的联合学习记忆即是将嗅觉信息与奖赏信号或者惩罚信号相关联并在脑内形成印迹。蘑菇体(mushroom body, MB)是记忆编码的关键脑区,在记忆形成、储存和提取过程中不可或缺。单侧脑半球内,蘑菇体的基本结构主要由近2000个Kenyon 细胞(KCs)组成。根据分支特征,KC可以分为三类:α/β、α′/β′、和γ神经元。这三类神经元的树突构成蘑菇体的萼部(Calyx),α/β和 α′/β神经元的轴突向脑前方投射,分枝构成水平叶和垂直叶,而γ 神经元不分枝仅构成水平叶。此外,20种多巴胺能神经元(dopaminergic neurons,DANs)的轴突末梢和21种蘑菇体输出神经元(mushroom output neurons,MBONs)的树突在蘑菇体的投射特征将蘑菇体水平叶和垂直叶区分为15个不同的亚结构域:γ1-5,β'1-2, β1-2,α'1-3和α1-3,表现出以亚结构域为基本功能的执行单元的特征 [1-3] (图1A)。这些多巴胺神经元和蘑菇体输出神经元也根据其在蘑菇体亚结构域的特异投射而被命名。
嗅觉信息的编码经嗅觉受体神经元传递到初级嗅觉编码中心触角叶(AL),再由投射神经元(PN)传递到KC。而奖赏信息和惩罚信息主要由不同类型的多巴胺神经元介导:PPL1神经元介导惩罚信息、参与厌恶性学习记忆;而PAM神经元在结构和功能上是异质的,除PAM-β2β'2a神经元外,大多数PAM神经元介导奖赏信息、参与奖赏性学习记忆[4-8] 。多巴胺神经元、蘑菇体KC神经元以及蘑菇体输出神经元,形成平行的、反馈的复杂环路,协同调控学习记忆。在文中,调控记忆不同阶段的神经元类型及已鉴定的功能性连接通过表格和示意图做了汇总和整理。
二、果蝇蘑菇体中调控睡眠的神经元和环路
蘑菇体环路不仅编码记忆,也在睡眠调控中发挥重要作用。早期的研究发现通过对分子或者蘑菇体环路进行时间和空间上的遗传操作,可改变睡眠。新近的研究将蘑菇体环路中参与睡眠调控的DANs、KCs、MBONs等神经元亚型、投射到蘑菇体的神经元类型鉴定出来,例如促进觉醒的有:多巴胺能神经元亚型PPL1-γ1pedc 和多种PAM亚型(-γ5β′2、-γ4、-γ4 < γ1γ2、-α1、-β1、-β2和-β′2a),蘑菇体神经元KC-α′/ β′和KC-γm,以及谷氨酸能蘑菇体输出神经元亚型MBON-γ5β′2a、-γ4 >γ1γ2, -β′2mp、和-β′2mp_bilateral;促进睡眠的有:DPM神经元、APL神经元,KC-γd,蘑菇体输出神经元亚型GABA能MBON-γ3和γ3β′1, 以及乙酰胆碱能MBON-γ2α′1等[9-13] 。
睡眠和记忆相互影响:在记忆不同阶段对果蝇进行睡眠剥夺将损害其认知能力[14-16] ;学习经历能促进睡眠需求[17] 。关于睡眠和记忆在神经元和环路层面如何连接已经有一些研究进展:DPM神经元开启了环路水平上睡眠和记忆整合研究。DPM除参与记忆形成、巩固和提取外,可以通过释放GABA来抑制促醒的α′/β′ KC神经元[10] 而促进睡眠。新近的研究揭示了睡眠依赖的记忆和睡眠非依赖的记忆的神经环路:PAM-α1和PPL1-γ1pedc→medial KC-α′/β′→MBON-γ1pedc>αβ环路介导睡眠非依赖性记忆,PAM-β′2mp和PPL1-γ1pedc→anterior-posterior KC-α′/β′→MBON-γ2α′1则在不同的动机状态下介导睡眠依赖性记忆[18, 19] (图1B),将果蝇睡眠和记忆的整合环路机制研究提升到了一个新的高度。
三、总结与展望:其他调控睡眠和记忆的整合局部环路和长投射环路
调控记忆和睡眠的蘑菇体环路仍然有很多空白:首先,蘑菇体中已鉴定的调控睡眠的PAM、MBONs、KCs等神经元类型:促醒的PAM(- γ 5β′2, -β1、-β2、-β'2a、-γ4和-γ4<γ1γ2),MBON(-β'2mp_bilateral、-γ4<γ1γ2),以及促睡的KC-γd、MBON(-γ2α′1、γ3、γ3 β′1)[9, 11-13] ,在调控记忆中是否发挥特异性的作用,与睡眠依赖或睡眠不依赖的环路的作用方式仍然未知。此外,已鉴定的蘑菇体多级的、平行的、反馈的记忆环路是否并如何与睡眠环路协同调控以应对复杂的内源性状态和不断变化的环境还存在大量未知。
除蘑菇体外,由神经小结(noduli)、椭球体(ellipsoid body,EB)、扇形体(fan-shaped body,FB)和原脑桥(protocerebral bridge,PB)构成的中央复合体,在处理复杂的时间信息、导航、运动控制以及睡眠调控中都发挥着重要的功能。尽管多种调控睡眠总量、睡眠结构和睡眠稳态的椭球体、扇形体神经元亚型被鉴定出来 [20, 21] ,但它们在记忆中的功能以及环路特征依旧未知。刘畅团队之前的工作发现,5-羟色胺输入椭球体的神经环路通过调控睡眠结构而影响记忆,且下游作用到蘑菇体、扇形体和原脑桥 [22] 。椭球体与蘑菇体、椭球体与扇形体,以及节律环路与椭球体等几个不同大脑结构之间如何形成长投射环路并共调控睡眠和记忆尚不清楚,有待进一步研究(图1C)。
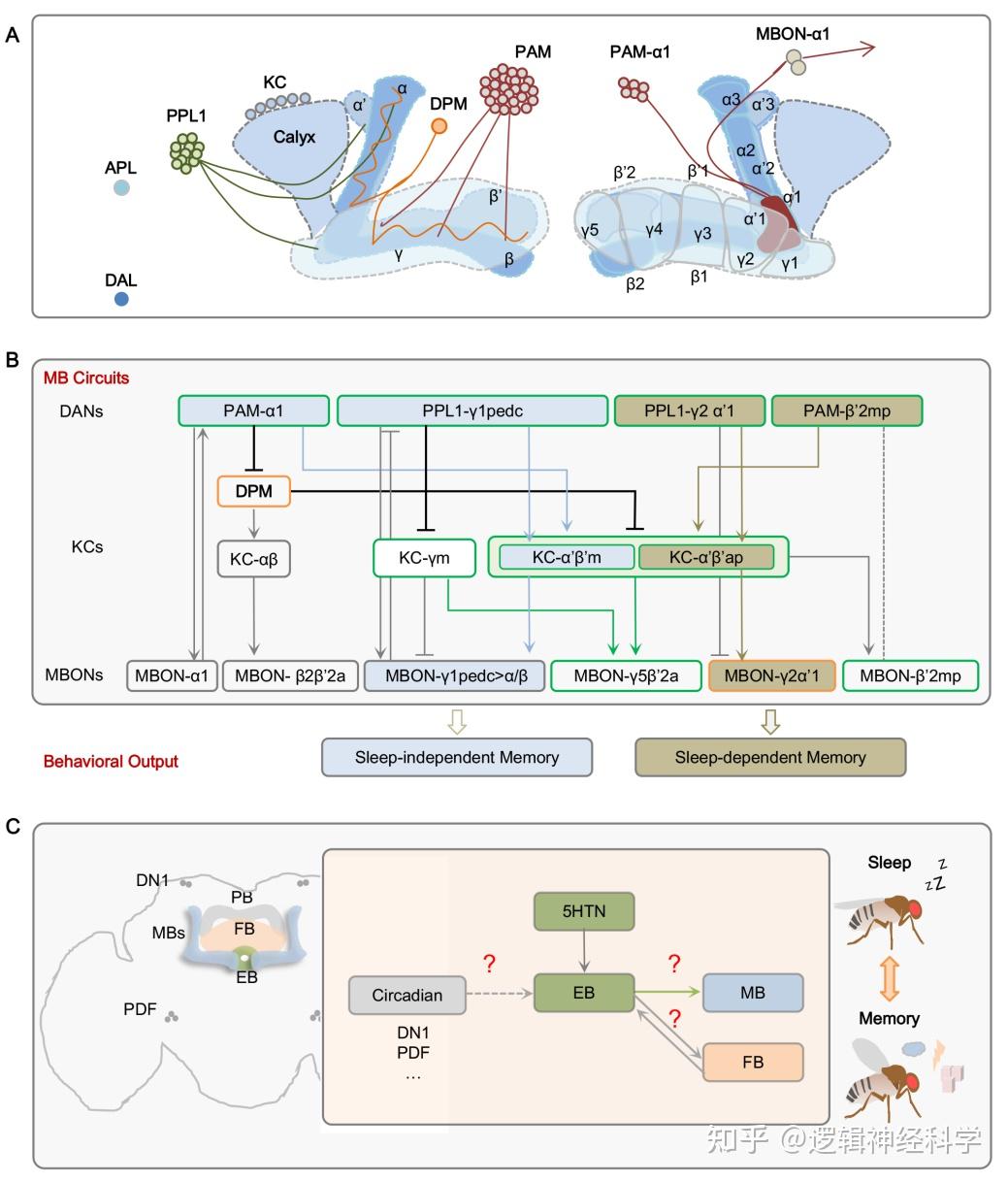
黑腹果蝇记忆中枢—蘑菇体结构及其与睡眠共享神经环路示意图(改自Wu and Liu, 2023)
(A)单侧蘑菇体由近2000个Kenyon 细胞(KCs)组成。根据分支特征,KC可以分为三类:α/β、α′/β′和 γ 神经元。蘑菇体中有20多种多巴胺能神经元(DANs)和21种蘑菇体输出神经元(MBONs),根据这两类神经元在蘑菇体的投射特征又将蘑菇体进一步区分为15个亚结构域:γ1-5,β'1-2, β1-2,α'1-3和α1-3,呈现出亚结构域的功能特异性和多样性。(B) 以蘑菇体为核心环路的睡眠依赖的(棕色)和睡眠不依赖的(蓝色)记忆环路示意图。平行的、反馈的多级蘑菇体神经环路有利于睡眠和记忆的精准调控,以应对复杂的、动态变化的内源性状态和外在环境。(C)其他潜在的睡眠和记忆共调控的整合环路。
综上所述,作者总结了果蝇这种简约但不简单的动物模型大脑中分别调节记忆和睡眠,以及共调控睡眠和记忆的细胞类型和神经环路,并提出未来从同一脑区(如蘑菇体)的局部环路水平、不同脑区之间的长投射环路水平以及全脑神经网络水平逐步拓展研究的思路,为全面解读睡眠和记忆共调控的神经环路机制提供了参考的模板。同行评议+给予该综述高度评价:“The manuscript by Wu and Liu deals with an interesting topic, attempting to link memory and sleep processes in the brain mainly by focusing on the olfactory associative circuit (i.e., the mushroom body) in Drosophila. I acknowledge the authors' efforts broadly covering complicated circuit compositions for memory and sleep processes by citing over 50 publications”. “The review provides up-to-date primary information and is presented in a structured manner”. “Your work will have great impact on your colleagues and peers, and help progress our field.”
原文链接:https://doi.org/10.1016/j.cois.2023.101105
第一作者:伍立桃,中国科学院深圳先进技术研究院,脑科学所,助理研究员,主持并参与国家自然科学基金+委项目,中国博士后科学基金项目,广东省基础与应用基础研究基金青年项目等,相关研究成果发表在Aging Cell,Journal of Neuroscience,Life Science Alliance等期刊。申请专利+7项,授权2项。
通讯作者:刘畅,中国科学院深圳先进技术研究院,脑科学所,研究员,博士生导师。
刘畅博士实验室:专注于睡眠和学习记忆的神经环路以及分子机制的研究,以及睡眠障碍+和认知衰退诊疗干预的新靶点和策略的研究。相关研究成果发表在Nature,PNAS,Current Biology,Journal of Neuroscience,npj Parkinson's Disease等国际知名期刊。主持国家自然科学基金委项目,中国科学院率先行动引才计划项目,广东省自然科学基金+等项目。申请专利共20项,授权10项,转让1项。中国科学院重点人才计划入选者,中国睡眠研究会+睡眠生理于药理专业委员会常务委员,中国细胞生物学学会生物节律分会常务委员,深圳市脑科学学会理事,深圳市医师协会神经调控专业委员会理事,担任多个SCI期刊的特邀审稿人+并担任《Neuroscience Bulletin》杂志青年编委。
博后招聘:刘畅团队前期工作不仅发现奖赏记忆的蘑菇体神经环路机制(Liu et al., 2012 Nature),还发现5 -羟色胺到椭球体(EB)环路通过调控睡眠结构而影响记忆,该环路下游靶点主要有记忆中枢蘑菇体(MB)、促睡中枢扇形体(FB)等 (Liu et al., 2019 Current Biology)。近期解析了睡眠时长和睡眠结构中的时空调控的椭球体细胞亚型 (Yan et al., 2023 the Journal of Neuroscience,封面文章)等。刘畅课题组欢迎致力于解析睡眠和记忆整合机制和改善睡眠和记忆障碍共患相关研究的博士后加入团队。我们将提供具有竞争力的薪酬待遇以及发展平台,有兴趣者请将个人简历及自愿提供的补充材料发送邮件到chang.liu3@siat.ac.cn。
转载须知:“逻辑神经科学”特邀稿件,且作者授权发布;本内容著作权+归作者和“逻辑神经科学”共同所有;欢迎个人转发分享,未经授权禁止转载,违者必究。
参考文献
[1] Tanaka N K, Tanimoto H, and Ito K: Neuronal assemblies of the Drosophila mushroom body. J Comp Neurol 2008, 508(5):711-755.
[2] Mao Z and Davis R L: Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil: anatomical and physiological heterogeneity. Front Neural Circuits 2009, 3(5)
[3] Aso Y, Hattori D, Yu Y, Johnston R M, Iyer N A, Ngo T T, Dionne H, Abbott L F, Axel R, Tanimoto H, and Rubin G M: The neuronal architecture of the mushroom body provides a logic for associative learning. Elife 2014, 3(e04577).
[4] Aso Y, Siwanowicz I , Bräcker L , Ito K , Kitamoto T, and Tanimoto H: Specific dopaminergic neurons for the formation of labile aversive memory. Curr Biol 2010, 20(16):1445-1451.
[5] Aso Y, Herb A, Ogueta M, Siwanowicz I, Templier T, Friedrich A B, Ito K, Scholz H, and Tanimoto H: Three dopamine pathways induce aversive odor memories with different stability. PLoS Genet 2012, 8(7):e1002768.
[6] Burke C J, Huetteroth W, Owald D, Perisse E, Krashes M J, Das G, Gohl D, Silies M, Certel S, and Waddell S: Layered reward signalling through octopamine and dopamine in Drosophila. Nature 2012, 492(7429):433-437.
[7] Liu C, Placais P Y, Yamagata N, Pfeiffer B D, Aso Y, Friedrich A B, Siwanowicz I, Rubin G M, Preat T, and Tanimoto H: A subset of dopamine neurons signals reward for odour memory in Drosophila. Nature 2012, 488(7412):512-516.
[8] Yamagata N, Ichinose T, Aso Y, Plaçais P Y, Friedrich A B, Sima R J, Preat T, Rubin G M, and Tanimoto H: Distinct dopamine neurons mediate reward signals for short- and long-term memories. Proc Natl Acad Sci U S A 2015, 112(2):578-583.
[9] Aso Y, Sitaraman D, Ichinose T, Kaun K R, Vogt K, Belliart-Guérin G, Plaçais P Y, Robie A A, Yamagata N, Schnaitmann C, Rowell W J, Johnston R M, Ngo T T, Chen N, Korff W, Nitabach M N, Heberlein U, Preat T, Branson K M, Tanimoto H, and Rubin G M: Mushroom body output neurons encode valence and guide memory-based action selection in Drosophila. Elife 2014, 3(e04580).
[10] Haynes P R, Christmann B L, and Griffith L C: A single pair of neurons links sleep to memory consolidation in Drosophila melanogaster. LID - 10.7554/eLife.03868 [doi] LID - e03868. Elife 2015, 4(e03868).[11] Sitaraman D, Aso Y, Rubin G M, and Nitabach M N: Control of Sleep by Dopaminergic Inputs to the Drosophila Mushroom Body. Front Neural Circuits 2015, 9:73.
[12] Sitaraman D, Aso Y, Jin X, Chen N, Felix M, Rubin G M, and Nitabach M N: Propagation of Homeostatic Sleep Signals by Segregated Synaptic Microcircuits of the Drosophila Mushroom Body. Curr Biol 2015, 25(22):2915-2927.
[13] Driscoll M, Buchert S N, Coleman V, McLaughlin M, Nguyen A, and Sitaraman D: Compartment specific regulation of sleep by mushroom body requires GABA and dopaminergic signaling. Sci Rep 2021, 11(1):20067.
[14] Li X, F Y, and Guo A: Sleep deprivation specifically impairs short-term olfactory memory in Drosophila. Sleep 2009, 32(11):1417-1424.
[15] Donlea J M, Thimgan Ms, Suzuki Y, Gottschalk L, and Shaw P J: Inducing sleep by remote control facilitates memory consolidation in Drosophila. Science 2011, 332(6037):1571-1576.
[16] Dag U, Lei Z, Le J, Wong A, Bushey D, and Keleman K: Neuronal reactivation during post-learning sleep consolidates long-term memory in Drosophila. Elife 2019, 8(e42786).
[17] Ganguly-Fitzgerald I, Donlea J, and Shaw P J: Waking experience affects sleep need in Drosophila. Science 2006, 313(5794):1775-1781.
[18] Chouhan N S, Griffith L C, Haynes P, and Sehgal A: Availability of food determines the need for sleep in memory consolidation. Nature 2021, 589(7843):582-585.
[19] Chouhan N S and Sehgal A: Consolidation of Sleep-Dependent Appetitive Memory Is Mediated by a Sweet-Sensing Circuit. J Neurosci 2022, 42(18):3856-3867.
[20] Hulse B, Haberkern H, Franconville R, Turner-Evans D, Takemura S, Wolff T, Noorman M, Dreher M, Dan C, Parekh R, Hermundstad A, Rubin G, and Jayaraman V: A connectome of the Drosophila central complex reveals network motifs suitable for flexible navigation and context-dependent action selection. LID - 10.7554/eLife.66039 [doi] LID - e66039. Elife 2021, 10(e66039).
[21] Yan W, Lin H, Yu J, Wiggin T D, Wu L, Meng Z, Liu C, and Griffith L C: Subtype-Specific Roles of Ellipsoid Body Ring Neurons in Sleep Regulation in Drosophila. J Neurosci 2023, 43(5):764-786.
[22] Liu C, Meng Z, Wiggin T D, Yu J, Reed M L, Guo F, Zhang Y, Rosbash M, and Griffith L C: A Serotonin-Modulated Circuit Controls Sleep Architecture to Regulate Cognitive Function Independent of Total Sleep in Drosophila. Curr Biol 2019, 29(21):3635-3646 e3635.